|
Esperienza di Joule
|
| |
|
Joule fece passare un filo conduttore in un recipiente contenete acqua, isolato termicamente dall’ambiente esterno. Misurò la differenza di potenziale e l’intensità di corrente per un determinato intervallo di tempo, ottenendo la quantità di energia elettrica trasformata in energia interna dell’acqua.
|
|
Dalla misurazione della variazione di temperatura dell’acqua, determinò che per innalzare di un grado la temperatura di un kilogrammo di acqua erano necessari 4186 J. Quindi 1kcal = 4186 J .
|
|
La quantità di energia elettrica, espressa in termini di lavoro è, come abbiamo visto prima:
|
| |
|
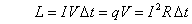
|
| |
|
Volendo esprimere la quantità di energia elettrica ceduta all’acqua in calorie Q, bisogna convertire il lavoro L, espresso in joule nel S.I., ovvero
|
| |
|
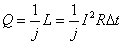
|
| |
|
j è una costante di conversione detta “equivalete meccanico della caloria”. Sperimentalmente vale appunto
|
|
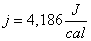
|
| |
|
Trasformazione di unità energia-calore:
|
| |
|
1 cal = 4.186 J
|
|
1 J = 0.2389 cal [1 kcal/h
= 1.153 W] |
| |
|
Le applicazioni pratiche basate sull’effetto Joule sono numerosissime; dalla lampadina elettrica, al forno, al ferro da stiro, etc.
|
![]()